
世界をリードする日本発の次世代療法
「BNCT」がこれからのがん治療を変える
2021年6月10日〜13日の4日間に渡り、第120回 日本皮膚科学会総会がパシフィコ横浜で開催された。総会では、次世代のがん治療法として注目されるBNCT(Boron Neutron Capture Therapy:ホウ素中性子捕捉療法)についてセミナーが開講され、国立がん研究センター中央病院・放射線治療科長の井垣浩氏、川崎医療福祉大学医療技術学部 診療放射線技術学科・学科長 特任教授の平塚純一氏、国立がん研究センター中央病院・前放射線治療科長の伊丹純氏が登壇し、皮膚科の先生方から大きな関心が寄せられた。BNCTの原理や確かな治療実績、現在進行中の臨床試験や今後の展望についての講演を紹介する。
■新たながん治療法として注目されるBNCT
現在、医療現場で行われる主ながん治療法として、外科的に腫瘍部位を摘出する手術療法、抗がん剤等を投薬する薬物治療、放射線を用いて腫瘍細胞を死滅させる放射線治療が挙げられる。BNCTはこの放射線治療の一種だが、がん治療の選択肢を広げる次世代療法として注目されている。
BNCTは、中性子とホウ素の原子核反応を利用して行われる。患者にホウ素を含む薬液を点滴した後、患部に体外から中性子線を照射する。照射に必要な時間は約30分〜1時間程度とされ、原則1回の照射で治療が完了するという。
一見すると従来の放射線治療と似ているが、患者負担の面から違いを考えるとBNCTの優位性が見えてくる。特筆すべきは照射回数だ。従来の放射線治療では数週間にわたり複数回の照射が必要だが、BNCTは1回の照射、つまり1日で治療可能であるため、通院回数は当然少なくて済み、患者負担の軽減に繋がる。
また、従来の放射線治療では、放射線が腫瘍細胞のみならず正常組織にも照射されるため、重篤な副作用も懸念される他、放射線治療後の再発症例に対しては基本的に再照射出来ない。
一方、BNCTは中性子線が腫瘍細胞に特異的に照射されるため、正常組織に優しい治療法と考えられており、従来の放射線治療後の再発症例に対しても実施可能だ。更に、BNCTの副作用は治療後数日間の倦怠感や悪心が見られる程度で済む場合がほとんどだ、と井垣氏は話す。
まるで良いところ尽くめのような治療法に、今世界中から熱い視線が注がれている。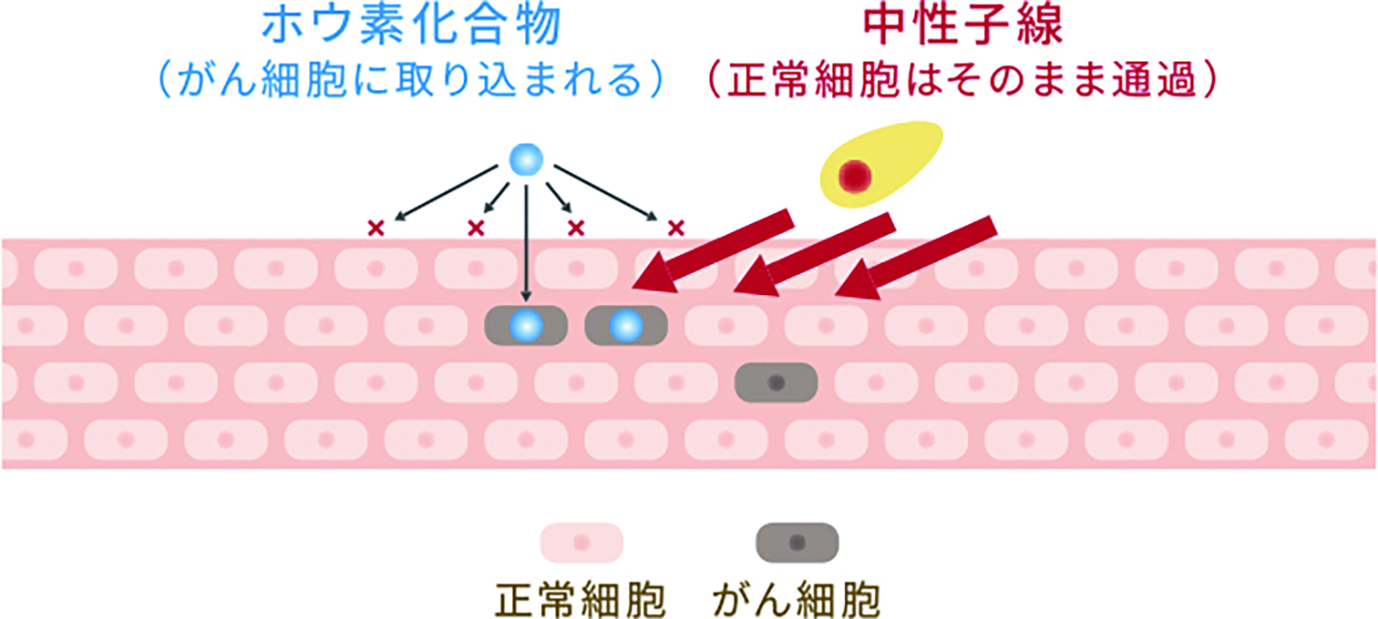
■夢のがん治療を実現するBNCTの原理
BNCTの最大の特長は、中性子線を腫瘍細胞に特異的に照射出来る点にある。この夢のようながん治療を実現するBNCTは、一体どのような原理に基づくのだろうか。
BNCTの治療ステップは大きく3段階に分かれる。
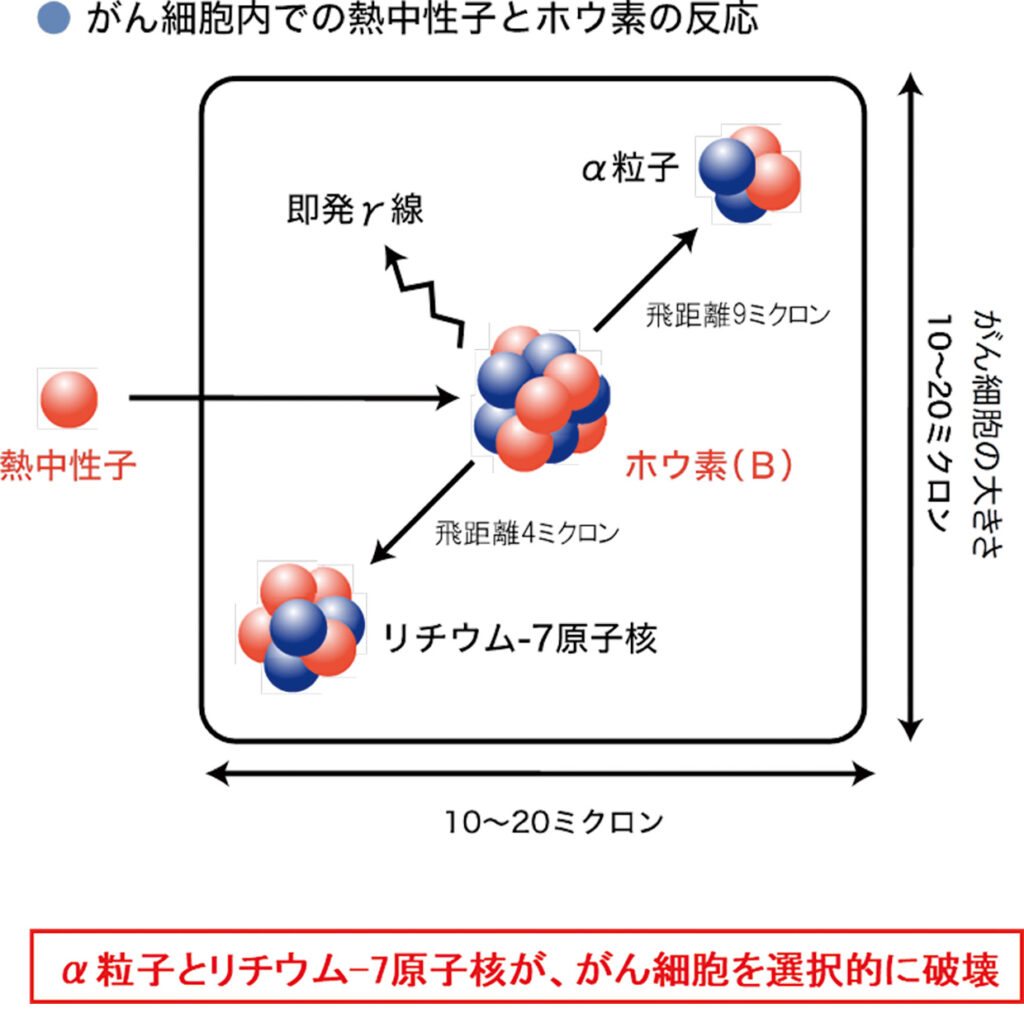
第1段階として、中性子と反応を起こすホウ素化合物(BPA)を患者に投与する。自然界において、ホウ素は質量数10の10Bと、質量数11の11Bが約2:8の比率で存在する。10Bは中性子と反応するが、11B は中性子と反応を起こさないため、BPAは10Bのみを濃縮して製造されるのだ。BPAは、LAT1と呼ばれるアミノ酸トランスポーターを介して体内に取り込まれるが、LAT1は腫瘍細胞に特異的に発現しており、正常組織ではほとんど発現しないとされる。結果的に、BPAが体内の腫瘍細胞に特異的に集積するというわけだ。BPAの代表例として、ステラファーマが開発した「ステボロニンR」が2020年3月に薬事承認され、頭頸部がんBNCT用薬剤として臨床応用されている。
第2段階として、中性子線を患者に照射する。ここで問題になるのが、どのようにして照射する中性子線を作り出すかだ。これまで原子炉が活用されてきたが、原子炉は法規制が厳しく保険診療を望めない上、特に震災後は廃炉を進める動きもある。このような状況下、加速器を用いた中性子照射装置が問題解決の糸口となった。
第3段階として、BPAと中性子の衝突が起こる。BPAに含まれる10Bが、照射された中性子線と原子核反応を起こし、粒子線の一種であるα線を生じさせる。α線がもたらすエネルギーは非常に強く、結果として腫瘍細胞のDNAが効率的に死滅する事で、抗腫瘍効果を示すというわけだ。
■BNCTが適応になる条件
 では、従来の放射線治療を全てBNCTに置き換えられるのだろうか。残念ながら、現段階での答えはノーだ。
では、従来の放射線治療を全てBNCTに置き換えられるのだろうか。残念ながら、現段階での答えはノーだ。
BNCTには、治療を得意とするがんと、そうでないがんがある。従来の放射線治療で用いるX線等に比べると、BNCTで用いる中性子線は直進性に欠け、身体の深部への透過性が低い。すなわち、身体の奥深くにある患部に中性子線が到達する事は難しく、体表から6〜7cmくらいの比較的浅部にあるがんがBNCTの対象になる。体表面に近い部位の腫瘍として、頭頸部がんや皮膚腫瘍、外陰部Paget病等が挙げられるが、これら以外にもX線抵抗性腫瘍や放射線治療後の局所再発症例に対する治療法として、BNCTが適しているとされる。
一方、身体の深部にある腹腔内の腫瘍や、広範囲に転移のある場合は、症状緩和の場合を除いてBNCTは不適と言われている。
また、実際にBNCTを行う前には、BPAにフッ素を付加した、FBPAと呼ばれる薬剤を用いたPET検査が有効だ。腫瘍細胞がBPAを取り込まなければ、そもそもBNCTの治療効果が期待出来ないため、FBPA-PET検査を行う事で治療対象になる腫瘍細胞へのホウ素集積能を事前に分析し、BNCTが有効であるかを最終確認することができる。
これらの条件をクリアした症例に対し、BNCT適応の判断が下される事になる。
■臨床研究におけるBNCTの現況
現在行われているBNCTの臨床研究について、セミナーで発表された内容を含めて紹介する。
国立がん研究センターでは、2010年よりBNCT開発プロジェクトを始動させ、翌11年には機器開発メーカーであるCICSと共同研究契約を締結し、臨床応用を進めてきた。14年より中性子照射装置を導入し、16年に原子力規制委員会による使用許可を取得、19年11月より企業主導治験を開始している。この治験は、希少がんである悪性黒色腫(メラノーマ)及び血管肉腫を対象としており、今年度中の第Ⅰ相試験終了が目標だ。メラノーマに対する研究は、腫瘍細胞がBPAを取り込み、ホウ素と複合体を形成する事に着目したもので、原子炉での豊富なBNCT経験を応用した形をとっている。
一方、血管肉腫に対する研究は、BPAの取り込みに関わるLAT1の発現が腫瘍細胞で高い事に着目したもので、原子炉でのBNCT経験が乏しい分、治験結果によっては今後の可能性が大いに評価されるだろう。
今回のセミナーでは発表されていないが、大阪医科薬科大学では、再発高悪性度髄膜腫を対象とした治験を実施している。高悪性度髄膜腫は脳や頭蓋骨、筋軟部組織、頭皮に浸潤し再発を繰り返す。また転移を起こしやすく、治りにくい腫瘍の1つである。
しかし、BNCTを実施し局所制御が良好であった研究結果も過去に示されており、今後の続報が期待されるところだ。
これらの他にも、膠芽腫や耳下腺がん等を対象とした複数の臨床試験が実施されている。膠芽腫は、脳腫瘍の1つである神経膠腫(グリオーマ)のうち、最も悪性の腫瘍とされている。放射線抵抗性である場合がほとんどで、放射線治療を行っても腫瘍の縮小が困難だ。
しかし、BNCT実施の2日後には腫瘍の縮小が認められた症例もあり、膠芽腫に対する高い抗腫瘍効果が期待されている。
耳下腺がんは、唾液の分泌を担う耳下腺から発生するがんで、頭頸部がんの1つに分類される。従来の放射線治療では、耳下腺や唾液腺への放射腺照射により唾液の分泌機能が低下する事から、患者は治療後、常に口渇状態のまま一生を送る事を余儀なくされる。
一方、BNCTであれば、中性子線照射による正常組織への影響を最低限に抑えられる可能性が高く、QOL維持の観点から臨床応用が待ち望まれている。
■BNCT 発展のための課題と今後の展望
これまでに、全世界で1000件以上のBNCTに関する臨床研究が実施されているが、研究実績の半数以上を日本が占めると言われている。引き続き日本がBNCT研究を牽引していくために、今何が求められているのだろうか。
原点に立ち戻れば、保険診療でBNCTを行うためには、BPAと加速器型中性子照射装置の2つが必要不可欠だ。すなわち、腫瘍に特異的に集積する高精度なBPAの開発、そして中性子照射装置の高性能化、小型化、低コスト化が主な課題となって浮かび上がる。
また、幅広いがん種を対象として被験者数を増やし、加速器型中性子照射装置を用いた臨床試験を積極的に行う事で、治験実績を確実に蓄積し、BNCTの有用性を示す必要があるだろう。メラノーマや悪性胸膜中皮腫は、近い将来適応拡大が見込まれる疾患として期待されているが、新たなホウ素薬剤の登場や中性子照射装置の改良が進めば、患者数が比較的多い肺がん、乳がん、肝がん、直腸がん等に対してBNCTが適応拡大される日も訪れよう。
このような課題を解決しつつ、更なるBNCTの発展を目指すためには、基盤技術の開発を行う研究拠点と連携した、医療拠点の整備が不可欠だ。そしてこの取り組みは、BNCT研究において世界をリードしてきた日本でこそ実現出来るものと期待されている。BNCTが主ながん治療法の1つとして確立され、多くのがん患者を救う時代はきっと近い。



LEAVE A REPLY